1、1個96T試劑盒能測多少個樣?
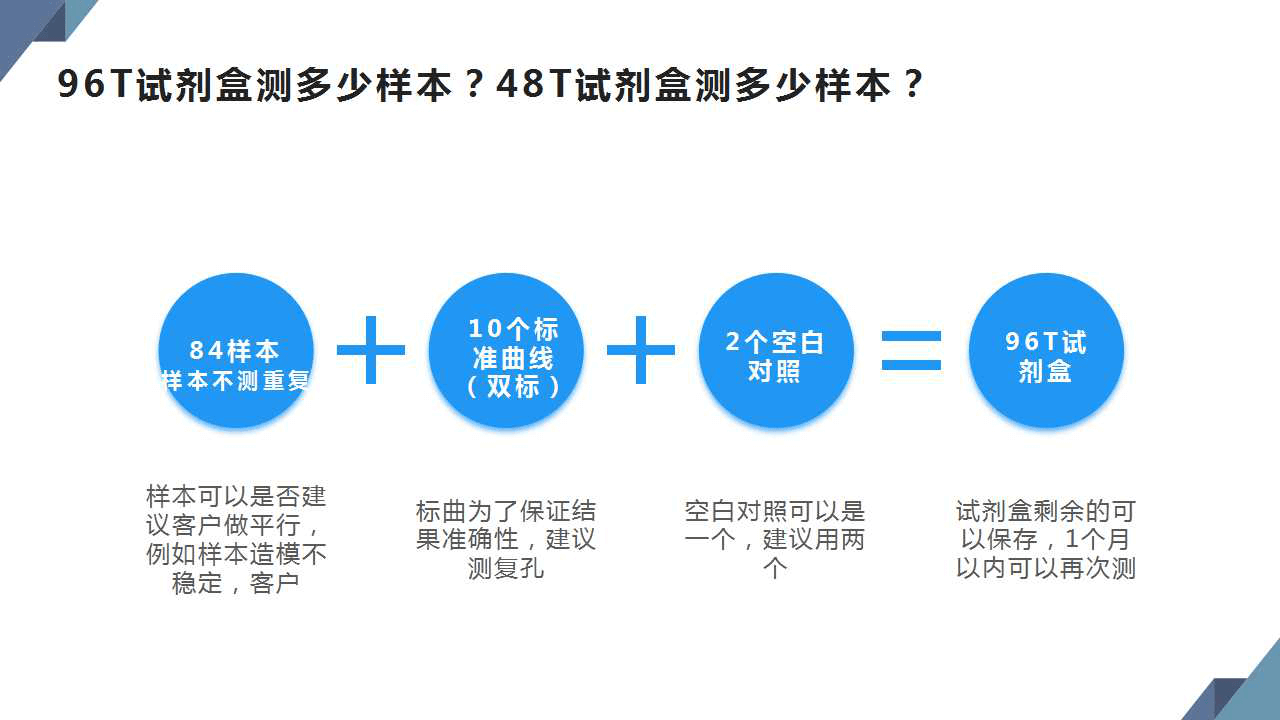
2、標準品500ml(96T/48T),能夠測多少次?
1)單標可以測四次
2)雙標可以測兩次
3、血液樣本如何選擇測ELISA?
1、血漿全血標本經抗凝分離后去除血細胞成分即為血漿,主要化學成分測定和凝血項目檢測等。
2、血清是血液離休凝固后分離出來的液體,血清與血漿相比較,主要是缺乏纖維蛋白原,某些凝血因子也發生了變化。血清主要用于化學和免疫學等檢測。
說明書上一般寫血漿和血清都可以檢測,根據需要選擇,例如:纖維蛋白原檢測用血漿樣本,血清樣本檢測纖維蛋白原殘留。
來源:劉成玉. 臨床檢驗基礎[M]. 2005.P5
4、血液樣本發生溶血是否能檢測?
輕微溶血勉強可以檢測,明顯溶血建議重新取樣,溶血因紅細胞破壞溶解時釋放大量具有過氧化物酶活性的血紅蛋白,在以辣根過氧化物酶為標記的ELISA,會導致非特異性顯色,干擾測定結果。
來源:
http://www.360doc.com/content/18/1207/05/52645714_799883575.shtml
5、組織樣本操作流程:
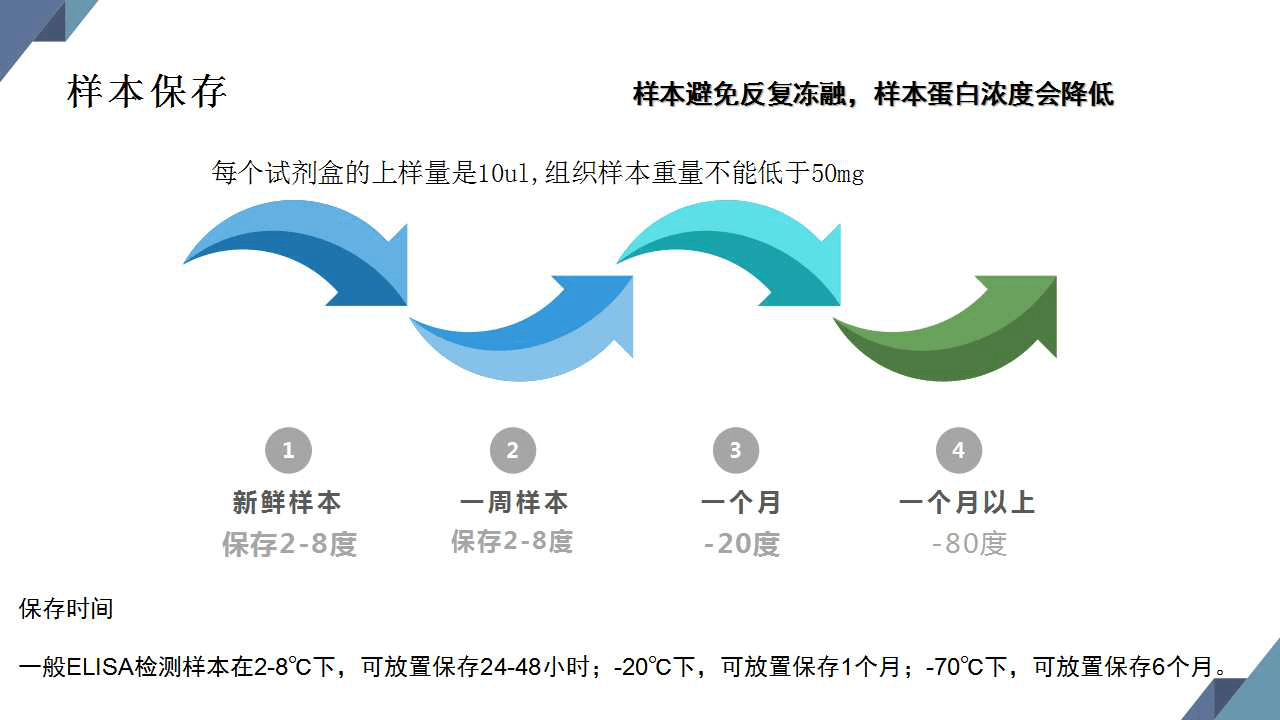
1) 組織樣本必須保持鮮重,如果是凍存的組織,應該室溫平行2小時以上,然后用生理鹽水沖洗干凈,再用濾紙把周圍的水分吸干,稱重!組織重量不能低于50mg;
2)組織勻漿液選取是PBS(PH=7.2-7.4,濃度為0.01mol/L)勻漿的比例為1:10,相當于1g組織加9ml的勻漿液;
3)組織勻漿后,離心取上清,離心轉數為5000轉,但不能超過5000轉,時間為15分鐘;
4) 實驗中樣本提取的是200mg的樣本加1.8ml的勻漿液。
6、組織樣本操作中的常見問題:
1)問:從各樣品中取了同樣大小的肉塊吧?具體是取了多少?怎么取的?稱重方式嗎?之前好像提到過肉塊大小的尺寸,是不是用其他方式做到了各樣品的起始量的一致?
答:對于組織,不可能確定好每塊組織都達到恒定的重量,這個不太現實。都是按照固定的勻漿比例(勻漿比例為10%),相當于1g組織加9ml的勻漿液,重量小的,勻漿液也會少。最終的濃度是不變的!
2)問:測定樣品時需要將樣品制成液體樣本吧?請問是如何做成液體樣品的?勻漿嗎?如果是勻漿方式的話應該有溶劑的,使用了哪些溶劑呢?
答:勻漿比例在上面已經告訴了,勻漿液采用的是0.01mol的PBS(磷酸鹽緩沖液)PH控制在7.2-7.4。
7、ELISA試劑盒操作細節常見問題整理:
1)問:是不是空白對照就是什么都不加?
答:不加樣本,不加樣本稀釋液,不加酶標試劑,其他都可以加。
2)問:樣本稀釋液是配好的嗎?
答:樣本稀釋液是配好的。
3)問:樣本稀釋液可以用來直接稀釋血清嗎?
答:可以的,直接加40ul就可以了。
4)問:洗滌液是濃縮的;是一次配好,還是現配現用?謝謝。
答:濃縮的,現配現用。
5)問:加入的顯色液A\B分別是什么物質?作用原理?
答:顯色劑A和B,是經典的TMB顯色系統。具體原理可以參考免疫方面的教科書。在這里不詳細列出。
6)問:終止液是什么物質?如何做到終止反應的?
答:終止液是2mol的硫酸溶劑。終止反應也是和原理相關。這個參考教科書!
7)問:稀釋液是什么成分?
答:標準稀釋液是PBS(PH=7.2-7.4,濃度是0.01mol/L)。樣本稀釋液是含有0.5%BSA的PBS(PH=7.2-7.4,濃度是0.01mol/L)。
8)問:需要避光保存的試劑是哪個?
答:需要避光的是顯色液B。
9)問:試劑盒從冰箱取出后,室溫放置會影響其效果嗎?
答:試劑盒在做實驗前應該要室溫平衡一小時。短時間(3、4小時)沒有任何影響。
10)問:樣品研磨后是立即離心,還是在4度冰箱里提取幾個小時以后再離心?
答:樣本研磨后立即離心即可。
補充:5%BSA 封閉液(Blocking Buffer)適用于 Western Blotting、ELISA 以及免疫組化實驗中非特異性蛋白結合位點的封閉。
8、樣本保存條件和時間怎么選擇?
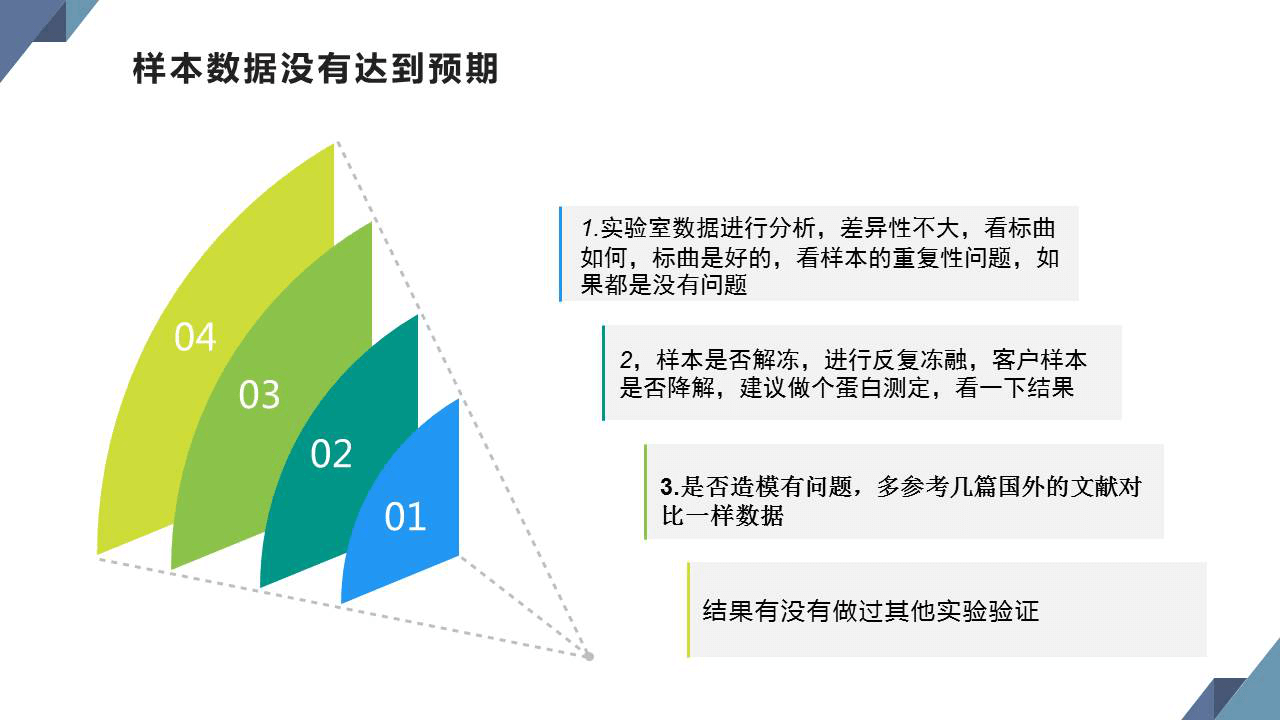
9、最后如果樣本數據沒有達到預期效果,不要慌,可以按下面流程排查問題,或者聯系公司技術。